上海第二類醫(yī)療器械注冊審評時間(2021年10月)——以醫(yī)護人員防護用品為例
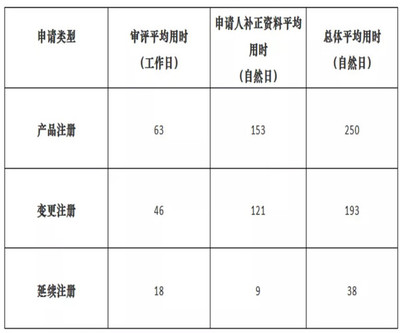
醫(yī)療器械的注冊審評時間是行業(yè)內(nèi)企業(yè)和研發(fā)機構(gòu)高度關(guān)注的關(guān)鍵環(huán)節(jié),它直接關(guān)系到產(chǎn)品的上市進度和市場布局。以上海市為例,其作為中國醫(yī)療器械產(chǎn)業(yè)的重要高地,對第二類醫(yī)療器械的注冊審評管理具有示范意義。本文將以2021年10月為時間參考點,結(jié)合當(dāng)時政策環(huán)境,重點探討醫(yī)護人員防護用品這類產(chǎn)品的注冊審評周期及相關(guān)要點。
一、 2021年10月上海第二類醫(yī)療器械注冊審評總體時限背景
根據(jù)國家藥品監(jiān)督管理局(NMPA)的統(tǒng)一要求,第二類醫(yī)療器械的技術(shù)審評法定時限為60個工作日(自受理之日起)。2021年,上海市藥品監(jiān)督管理局(SHFDA)持續(xù)推進審評審批制度改革,優(yōu)化流程,力圖在法定時限內(nèi)高效完成審評。對于技術(shù)資料清晰、臨床評價路徑明確、風(fēng)險可控的產(chǎn)品,審評周期通常較為穩(wěn)定。但具體時長會受到產(chǎn)品復(fù)雜性、資料完整性、是否需要專家審評或補充資料等多種因素影響。
二、 醫(yī)護人員防護用品的分類與審評特點
醫(yī)護人員防護用品,如醫(yī)用防護口罩、醫(yī)用外科口罩、防護服、隔離衣、醫(yī)用隔離面罩/眼罩等,在《醫(yī)療器械分類目錄》中多歸屬于“14注輸、護理和防護器械”大類下的“醫(yī)護人員防護用品”子目錄。在2021年,尤其是后疫情時代,這類產(chǎn)品因其重要的公共衛(wèi)生意義,審評審批工作備受重視。
其審評特點包括:
- 風(fēng)險關(guān)注點集中:審評重點關(guān)注產(chǎn)品的過濾效率(對于口罩)、液體阻隔性能(對于防護服、隔離衣)、生物相容性、微生物指標等核心安全有效性指標。
- 標準體系相對完善:相關(guān)國家標準(GB)和行業(yè)標準(YY,如GB 19083-2010, YY 0469-2011, GB 19082-2009等)較為明確,為企業(yè)準備資料和審評機構(gòu)進行判斷提供了清晰依據(jù)。
- 臨床評價路徑:多數(shù)醫(yī)護人員防護用品可通過同品種比對路徑進行臨床評價,無需開展臨床試驗,這在一定程度上縮短了整體注冊準備時間,但對比資料的充分性和合規(guī)性是審評關(guān)鍵。
三、 影響審評時間的具體因素(以2021年10月為參照)
盡管有法定時限,但從受理到最終獲批的實際周期可能會因以下因素波動:
- 資料質(zhì)量:這是最關(guān)鍵的因素。申報資料(包括產(chǎn)品技術(shù)要求、研究資料、檢驗報告、臨床評價資料、生產(chǎn)制造信息等)是否完整、規(guī)范、數(shù)據(jù)翔實,直接決定了審評員進行技術(shù)審評的效率。一次提交即符合要求,是保證在60個工作日內(nèi)完成審評的基礎(chǔ)。
- 補充資料環(huán)節(jié):若在審評過程中發(fā)現(xiàn)需要企業(yè)補充資料或說明,審評計時將中止。企業(yè)補充資料的時間不計入審評時限,但會拉長整個注冊周期。2021年,上海局也在推行“一次性補正”等溝通機制,以提高補正效率。
- 產(chǎn)品創(chuàng)新性與復(fù)雜性:雖然防護用品多為成熟產(chǎn)品,但若涉及新材料、新工藝或聲稱具有特殊功能(如抗病毒、可重復(fù)使用等),可能需要更深入的審評和驗證,或啟動專家咨詢,時間可能延長。
- 檢驗與體系核查:產(chǎn)品檢驗(注冊檢驗)和質(zhì)量管理體系核查是注冊的前置或并行環(huán)節(jié)。在2021年,這些環(huán)節(jié)的銜接順暢度也會影響整體時間表。
- 行政流程與溝通效率:與審評部門的有效溝通、對于審評意見的及時響應(yīng),都影響著進程。
四、 與建議
回顧2021年10月的時間節(jié)點,對于計劃在上海申報第二類醫(yī)護人員防護用品的企業(yè)而言,一個相對順利的注冊審評周期(從受理到獲批)目標可設(shè)定在4-7個月左右(此時間為整體周期估算,其中技術(shù)審評法定時限為60個工作日)。這建立在資料高質(zhì)量準備、檢驗提前完成、體系核查順利的前提下。
給相關(guān)企業(yè)的核心建議是:
- 深入研究法規(guī)與標準:精準把握《醫(yī)療器械注冊管理辦法》、《醫(yī)療器械臨床評價技術(shù)指導(dǎo)原則》以及產(chǎn)品對應(yīng)的具體國家標準和行業(yè)標準。
- 注重注冊資料質(zhì)量:將“一次性通過”作為資料準備的目標,確保所有研究數(shù)據(jù)真實、完整、可追溯,臨床評價路徑選擇正確、比對證據(jù)充分。
- 提前規(guī)劃與全程管理:將產(chǎn)品檢驗、體系核查、資料撰寫與提交進行一體化規(guī)劃,留出充足的準備和溝通時間。
- 關(guān)注政策動態(tài):醫(yī)療器械法規(guī)政策處于持續(xù)優(yōu)化中,即使回顧2021年的情況,也應(yīng)關(guān)注后續(xù)政策的調(diào)整,以便更好地規(guī)劃當(dāng)前及未來的注冊工作。
總而言之,2021年10月,上海對第二類醫(yī)療器械(包括醫(yī)護人員防護用品)的注冊審評工作在法定框架內(nèi)力求高效。企業(yè)通過提升自身注冊申報的專業(yè)性和規(guī)范性,是確保產(chǎn)品順利、快速上市的最可靠途徑。
如若轉(zhuǎn)載,請注明出處:http://www.mcfadden.com.cn/product/54.html
更新時間:2026-01-22 10:45:29